黒ボク土からも高収率でDNA回収
Extrap® Soil DNA Kit Plus Ver.2
| 土壌、活性汚泥などの広範な環境試料から、高純度の微生物等のDNAを抽出・精製するキットです。環境試料に存在する微生物の群集構造解析やリアルタイム定量PCRなどのアプリケーションに適しています。 黒ボク土からも高収率でのDNA抽出が行えます。 |  |
製品の特長
Bead tubeに含まれた破砕用ビーズを用いて微生物細胞を破砕し、DNAを抽出します。
DNAの土壌粒子への吸着を抑制する独自の添加剤が含まれており、高い収率でDNAを回収することができます。
得られたDNA溶液中には阻害物質が少ないため、原液をそのままPCRに使用可能です。
DNAの精製に磁気ビーズを採用しているため、操作が簡便かつ自動化にも対応しています。
ボルテックスミキサーで微生物細胞を破砕した場合でも、ビーズビーダーを使用した場合とほぼ同等の結果が得られます。
容量:50回分
磁気ビーズのDNA吸着容量:10~20μg
使用例
優れたDNA抽出効率
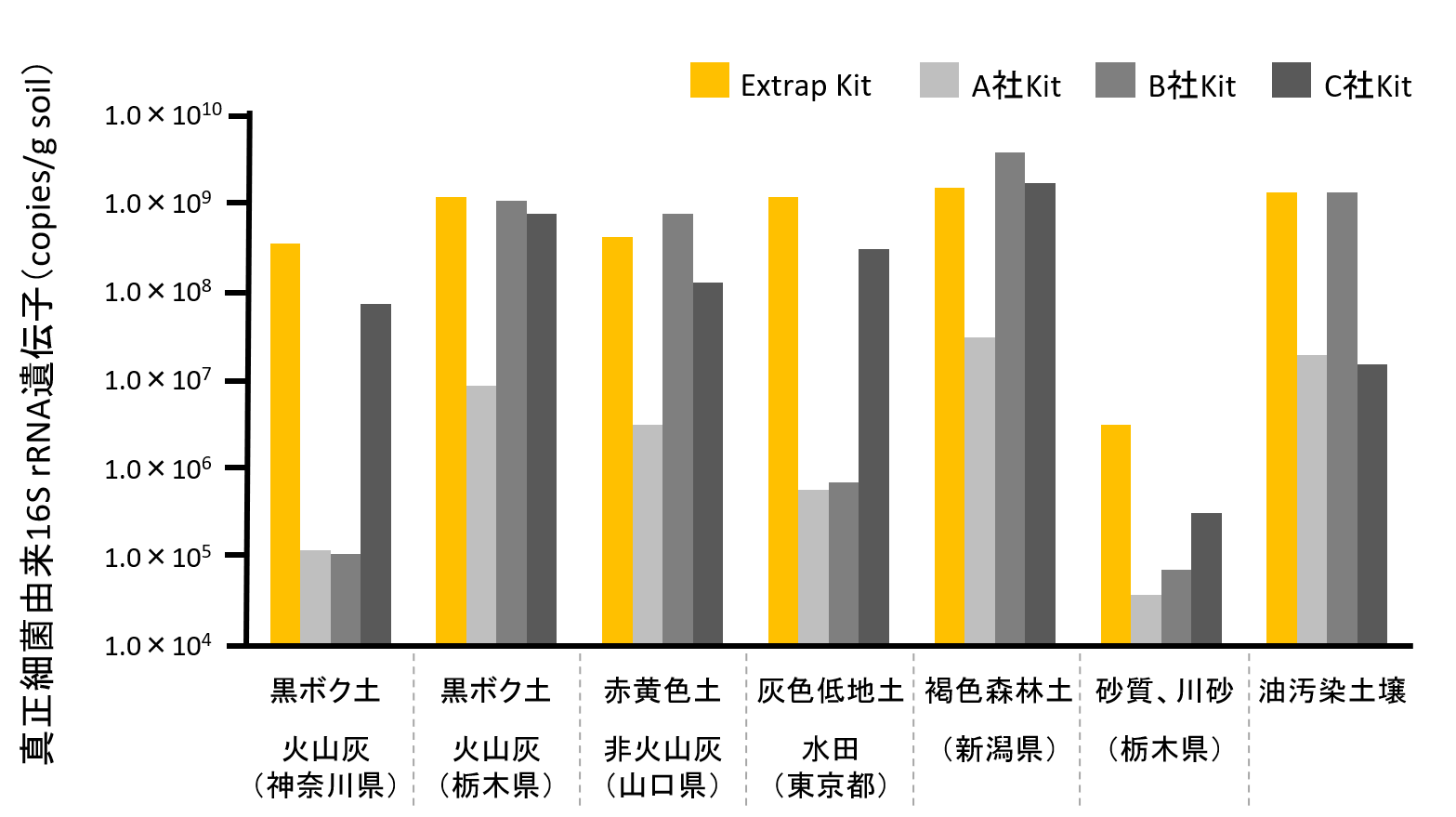
一般的にDNA抽出が困難とされる土壌について他社キットとの比較試験を実施した。
Extrap Soil DNA Kit Plus Ver2と他社キット3種について7種の土壌でDNA抽出を行った結果、すべての土壌において他社製品と同等またはそれ以上の測定値が得られた。Extrap Soil DNA Kit Plus Ver2は土壌に限らず、多種多様な環境試料から高純度・高収量でDNAを回収することができる。
微生物の存在量が少ない環境試料からのDNA抽出にも使用可能
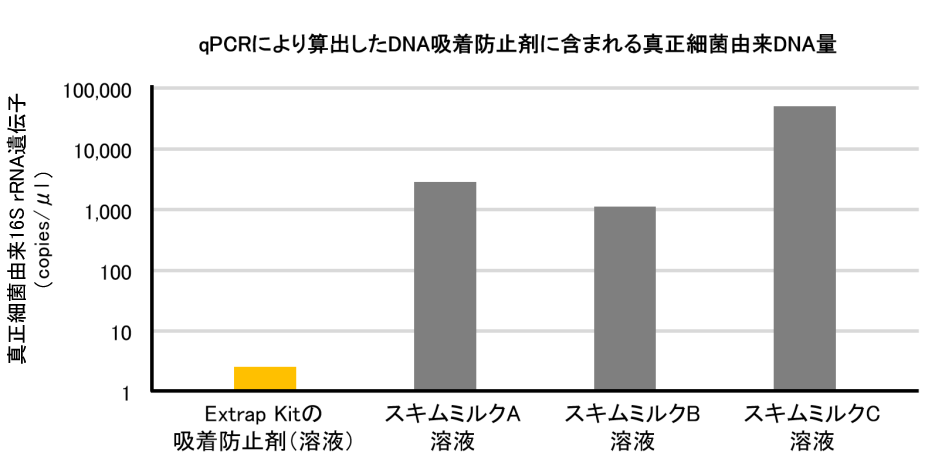
日本の土壌は黒ボク土の影響により、DNAを吸着しやすい性質がある。DNA抽出バッファーにスキムミルクを添加することで、 DNAの土壌への吸着を防止する手法が知られているが、スキムミルクには微生物由来DNAが微量に含まれている可能性があり(上図参照)、精製DNAへのキャリーオーバーが生じる恐れがある。しかし、Extrap Kitが採用するDNA吸着防止剤は、微生物由来DNAの含有量が2.6 copies/μlと極めて少ないため、精製DNAへの影響が極めて小さい。したがって、Extrap Kitは微生物存在量が少ない環境試料からのDNA抽出にも使用できる。
その他の使用例、比較例についてはこちら
操作方法概略
細胞破砕(ビーズビーティング)
(1) Bead tubeに土壌試料0.5g、Extraction buffer、Lysis solutionを添加し、ビーズビーティング(30~45秒間)。
(2) 遠心(5分)、上清採取。
↓
タンパク質除去
(3) PP solutionを添加し、遠心(5分)、上清採取。
↓
磁性ビーズによる精製(磁性ビーズのセパレーターはこちら
)
(4) MBs solution、Binding solutionを添加し、攪拌(2分)、集磁、上清廃棄。
(5) Washing solutionを添加し、攪拌、集磁、上清廃棄。
(6) エタノール水溶液を添加し、攪拌、集磁、上清廃棄。
↓
DNA溶出
(7) 風乾後、溶出液を添加し、65℃で5~10分加温。
(8) 集磁、上清採取 → total DNA。
自動化の実績もあります。
使用文献
Ryoma K., et al., Sci. Adv., 8, (17), eabi5075 (2022).
Keiichi N., et al., Scientific Reports, 13, 2210 (2023).
Hiroyuki H., et al., Food Chemistry, 5, 100123 (2022).
Mutsumi S., et al., Chemosphere, 244, 125381 (2020).
Sandrine B., et al., Science of The Total Environment, 84, 152508 (2022).
Takashi A., et al., Science of The Total Environment, 766, 142568 (2021).
Takashi A., et al., Antibiotics , 11, (2), 210 (2022).
Akotchiffor K. G. D., et al., Mycorrhiza, 34, 119~130 (2024).
Yuki O., et al., Odontology, 112, (2), 588~600 (2024).
Ryosuke N., et al., Microbiol. Resour .Announc., 13, (3), e0127023 (2024).
Masataka A., et al., PLoS One, 18, (9), e0291742 (2023).
Daiki O., et al., BioEnergy Research, 16, 2168~2177 (2023).
Shini K., et al., Int. J. Mol. Sci., 24, (5), 4603 (2023).
Shin-Ichi H., et al., Appl. Environ. Microbiol., 89, (11), e0148823 (2023).
Takuya K., et al., Front. Ecol. Evol., 10, 959945 (2022).
Mutsumi S., et al., Biomass and Bioenergy, 164, 106551 (2022).
Wataru A., et al., Front Microbiol., 13, 1024640 (2022).
Kaho Y., et al., Water Sci. Technol., 85, (7), 2254~2264 (2022).
Zuoqian L., et al., Bioscience, Biotechnology, and Biochemistry, 86, (1), 117~124 (2021).
Miki K., et al., Bioscience, Biotechnology, and Biochemistry, 86, (12), 1705~1717 (2022).
Takashi A., et al., Antibiotics, 11, (2), 210 (2022).
Noriko T., et al., J. Water Health, 19, (4), 657~670 (2021).
Yuki I., et al., Applied and Environmental Microbiology, 10, (48), e01025-21 (2021).
Hiroki N., et al., Microbes and Environments, 36, (4), ME21029 (2021).
Yukiyo Y., et al., New Phytologist, 231, (5), 2029~2038 (2021).
Yuyao Z., et al., Water Sci. Technol., 83, (7), 1511~1521 (2021).
Rika K., et al., Microbes and Environments, 36, (2), ME20148 (2021).
Yasuko Y., et al., Microorganisms , 9, (6), 1133 (2021).
Kimiho O., et al., Extremophiles, 25, 61~76 (2021).
Kenji T., et al., PLoS One, 15, (2), e0229740 (2020).
Hiroki N., et al., Bioscience, Biotechnology, and Biochemistry, 84, (9), 1921~1935 (2020).
Shogo T., et al., Journal of Water and Environment Technology, 17, (2), 67~75 (2019).
Kimiho O., et al., Archives of Microbiology, 201, 969~982 (2019).
Kenji T., et al., Limnology and Oceanography, 64, (6), 2441~2454 (2019).
Taira H., et al., Water Sci. Technol., 80, (12), 2320~2327 (2019).
Raphaël M., et al., The ISME Journal, 14, 2907~2922 (2020). (Reference 29)
Kohei I., et al., The ISME Journal, 12, 31~47 (2018).
Jing Y., et al., Int. J. Environ. Res. Public Health, 15, (6), 1252 (2018).
Sri M., et al., asain journal of pharmaceutical and clinical research , 11, (6), 186~189 (2018).
Michio F., et al., PLoS One, 12, (12), e0189609 (2017).
Alex W., et al., The ISME Journal, 11, (8), 1915~1929 (2017).
Kentaro M., et al., Front. Bioeng. Biotechnol., 5:14 (2017).
Yasuko Y., et al., FEMS Microbiology Ecology, 91, (9), fiv093 (2015).
Kenji T., et al., Journal of Oceanography, 71, 675~683 (2015).
Yuki H., et al., Case Rep. Ophthalmol., 3, (3), 291~297 (2012).
関連製品:磁気ビーズ用マグネティックラック
 |
|


BDLはフナコシグループの一員です。
BDL製品をご購入の際は、フナコシ株式会社製品取扱い販売店にご注文ください。
…実験お役立ち情報…
実験に役⽴つTIPSや基本情報をご提供します
 JP
JP